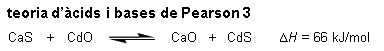teorema d'Euler
teorema d'Euler
Química física
- ca teorema d'Euler, n m
- es teorema de Euler, n m
- en Euler's theorem, n
Química física
Definición
Teorema segons el qual les funcions d'estat en funció de les seves variables naturals, que poden ser variables extensives o variables intensives, sempre es poden posar com a suma només de les variables extensives multiplicades per les seves variables conjugades.
Nota
-
Per exemple, l'energia interna té com a variables naturals l'entropia, el volum i la quantitat de substància, i la seva variació s'expressa com dU = TdS − pdV + ∑(μid ni). Per tant, l'energia interna es pot expressar com U = TS − pV + ∑(μid ni).
En canvi, l'energia de Gibbs només té com a variable extensiva la quantitat de substància, i la seva variació s'expressa com dG = − SdT + Vdp + ∑(μid ni). Per tant, l'energia de Gibbs s'expressarà com G = ∑(μid ni), ja que les altres variables naturals són la temperatura i la pressió, que són variables intensives.
Quan la funció d'estat té com a variables naturals només variables intensives, el teorema d'Euler estableix que aquesta funció d'estat és idènticament nul·la, i de la seva diferencial s'obté l'equació de Gibbs-Duhem, que, de fet, és una relació entre variacions de variables intensives idènticament nul·la.
teorema de Carnot
teorema de Carnot
Química física
- ca teorema de Carnot, n m
- es teorema de Carnot, n m
- en Carnot's theorem, n
Química física
Definición
Teorema derivat del segon principi de la termodinàmica segons el qual cap màquina tèrmica que treballi entre dos focus de temperatures constants pot tenir un rendiment més gran que el d'una màquina tèrmica reversible que funcioni entre els mateixos focus.
Nota
-
Entre dos focus determinats, totes les màquines tèrmiques reversibles tenen el mateix rendiment. Per tant, el rendiment màxim només depèn de les temperatures dels focus i no de la naturalesa del sistema que realitza el cicle.
El teorema de Carnot va ser introduït per S. Carnot el 1824 a partir de la teoria del calòric.
teorema de la calor de Nernst
teorema de la calor de Nernst
Química física
- ca teorema de la calor de Nernst, n m
- es teorema del calor de Nernst, n m
- en Nerst heat theorem, n
Química física
Definición
Teorema segons el qual la variació de l'energia de Gibbs per a un procés isotèrmic tendeix a zero a mesura que la temperatura a què es realitza el procés s'acosta al zero absolut, per tant, la variació de l'entropia en un procés isotèrmic s'anul·la en el límit en què la temperatura tendeix a zero.
Nota
-
El teorema de la calor de Nernst permet afirmar que, en el zero absolut, una corba isoterma en un diagrama d'estats pV coincideix amb la corba isoterma. D'aquí es deriva el principi de la inaccessibilitat del zero absolut.
El teorema de la calor de Nernst és previ a l'enunciat de Nernst-Simon, del qual es considera equivalent.
teoria d'àcids i bases d'Arrhenius
teoria d'àcids i bases d'Arrhenius
Química inorgànica
- ca teoria d'àcids i bases d'Arrhenius, n f
- es teoría de ácidos y bases de Arrhenius, n f
- en Arrhenius acid-base theory, n
Química inorgànica
Definición
Teoria d'àcids i bases segons la qual, en dissociar-se en solució aquosa, els àcids donen ions hidrogen (H+) i les bases donen ions hidròxid (OH-).
Nota
-
L'àcid clorhídric és un àcid d'Arrhenius, ja que en solució aquosa dona ions hidrogen: HCl → H+ + Cl−. L'hidròxid de sodi és una base d'Arrhenius, ja que en solució aquosa dona ions hidròxid: NaOH → Na+ + OH−.
La teoria d'àcids i bases d'Arrhenius no permet explicar per què algunes substàncies que no contenen ions hidròxid, com l'amoníac (NH3), l'òxid de bari (BaO) o el carbonat de sodi (Na2CO3), presenten propietats característiques de les bases.
Vegeu també Vegeu també teoria d'àcids i bases de Brønsted i teoria d'àcids i bases de Lewis.
teoria d'àcids i bases de Brønsted
teoria d'àcids i bases de Brønsted
Química analítica, Química inorgànica
- ca teoria d'àcids i bases de Brønsted, n f
- ca teoria d'àcids i bases de Brønsted i Lowry, n f
- ca teoria de Brønsted i Lowry, n f sin. compl.
- es teoría de ácidos y bases de Brønsted, n f
- es teoría de ácidos y bases de Brønsted y Lowry, n f
- es teoría de Brønsted y Lowry, n f
- en Brønsted acid-base theory, n
- en Brønsted-Lowry acid-base theory, n
- en Brønsted-Lowry theory, n
Química analítica, Química inorgànica
Definición
Teoria d'àcids i bases que es fonamenta en la transferència de protons, segons la qual els àcids actuen com a donadors de protons i les bases actuen com a acceptors de protons H+ o, si es tracta d'una solució aquosa, H3O+.
Nota
-
Aquesta definició dona lloc al concepte de parell acidobàsic conjugat, el conjunt format per un àcid i una base relacionats pel guany o la pèrdua d'un únic protó.
A diferència de la teoria d'àcids i bases d'Arrhenius, la teoria d'àcids i bases de Brønsted té en compte l'efecte del dissolvent en l'equilibri d'una manera molt activa acceptant o cedint protons, com per exemple HCl + H2O → Cl− + H3O+. Així doncs, un àcid només es pot dissociar en un dissolvent capaç d'acceptar protons, és a dir, que tingui caràcter bàsic, i una base només es pot dissociar en un dissolvent que pugui cedir-li protons, és a dir, que tingui caràcter àcid. En aquest cas, es pot tractar d'un dissolvent protofílic, un dissolvent protogènic, un dissolvent amfipròtic o un dissolvent apròtic.
Això fa que les característiques acidobàsiques d'una substància química siguin molt diferents segons el dissolvent amb què interactua. Així, per exemple, la urea es comporta com una base feble en dissolució aquosa (segons H2NCONH2 + H2O → H2NCONH3+ + OH−), com una base forta en presència d'àcid acètic (segons H2NCONH2 + CH3COOH → H2NCONH3+ + CH3COO−) o bé com un àcid en presència d'amoníac líquid (segons H2NCONH2 + NH3 → H2NCONH− + NH4+).
Les forces relatives dels àcids de Brønsted són definides per la constant d'acidesa, que sovint s'expressa en valors de pKA.
Vegeu també teoria d'àcids i bases de Lewis.
teoria d'àcids i bases de Brønsted i Lowry
teoria d'àcids i bases de Brønsted i Lowry
Química analítica, Química inorgànica
- ca teoria d'àcids i bases de Brønsted, n f
- ca teoria d'àcids i bases de Brønsted i Lowry, n f
- ca teoria de Brønsted i Lowry, n f sin. compl.
- es teoría de ácidos y bases de Brønsted, n f
- es teoría de ácidos y bases de Brønsted y Lowry, n f
- es teoría de Brønsted y Lowry, n f
- en Brønsted acid-base theory, n
- en Brønsted-Lowry acid-base theory, n
- en Brønsted-Lowry theory, n
Química analítica, Química inorgànica
Definición
Teoria d'àcids i bases que es fonamenta en la transferència de protons, segons la qual els àcids actuen com a donadors de protons i les bases actuen com a acceptors de protons H+ o, si es tracta d'una solució aquosa, H3O+.
Nota
-
Aquesta definició dona lloc al concepte de parell acidobàsic conjugat, el conjunt format per un àcid i una base relacionats pel guany o la pèrdua d'un únic protó.
A diferència de la teoria d'àcids i bases d'Arrhenius, la teoria d'àcids i bases de Brønsted té en compte l'efecte del dissolvent en l'equilibri d'una manera molt activa acceptant o cedint protons, com per exemple HCl + H2O → Cl− + H3O+. Així doncs, un àcid només es pot dissociar en un dissolvent capaç d'acceptar protons, és a dir, que tingui caràcter bàsic, i una base només es pot dissociar en un dissolvent que pugui cedir-li protons, és a dir, que tingui caràcter àcid. En aquest cas, es pot tractar d'un dissolvent protofílic, un dissolvent protogènic, un dissolvent amfipròtic o un dissolvent apròtic.
Això fa que les característiques acidobàsiques d'una substància química siguin molt diferents segons el dissolvent amb què interactua. Així, per exemple, la urea es comporta com una base feble en dissolució aquosa (segons H2NCONH2 + H2O → H2NCONH3+ + OH−), com una base forta en presència d'àcid acètic (segons H2NCONH2 + CH3COOH → H2NCONH3+ + CH3COO−) o bé com un àcid en presència d'amoníac líquid (segons H2NCONH2 + NH3 → H2NCONH− + NH4+).
Les forces relatives dels àcids de Brønsted són definides per la constant d'acidesa, que sovint s'expressa en valors de pKA.
Vegeu també teoria d'àcids i bases de Lewis.
teoria d'àcids i bases de Lewis
teoria d'àcids i bases de Lewis
Química analítica, Química inorgànica
- ca teoria d'àcids i bases de Lewis, n f
- ca teoria de Lewis, n f sin. compl.
- es teoría ácido-base de Lewis, n f
- es teoría de Lewis, n f
- en Lewis acid-base theory, n
- en Lewis theory, n
Química analítica, Química inorgànica
Definición
Teoria d'àcids i bases que es fonamenta en la transferència de parells d'electrons.
Nota
-
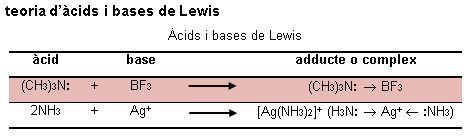
El fet que la teoria d'àcids i bases de Lewis es fonamenti en la transferència de parells d'electrons la diferencia de la teoria d'àcids i bases d'Arrhenius i de la teoria d'àcids i bases de Brønsted, en els quals la partícula de referència és el protó. Així, una base és una substància que pot cedir com a mínim un parell d'electrons i un àcid és una substància que pot acceptar com a mínim un parell d'electrons (vegeu la imatge).
De resultes de la donació d'un parell d'electrons es forma l'enllaç covalent datiu i la molècula resultant és un complex. El donador del parell d'electrons és un lligand i pot ser aniònic, com el Cl-, o neutre, com l'amoníac.
L'orbital buit que accepta els electrons pot ser un orbital s, com en el cas del H+; un orbital p, com en el cas del BF3; un orbital d, com en el cas del Co2+, o un orbital f, com en el cas del U6+. Com més petit sigui el catió i més gran la relació entre la càrrega elèctrica i el radi, més fort serà el caràcter d'àcid de Lewis de l'ió envers bases de Lewis com ara l'amoníac o l'aigua.
Si una molècula té un orbital donador i un orbital buit, pot actuar alhora tant com a àcid de Lewis o com a base de Lewis, com ara el diòxid de sofre.
teoria d'àcids i bases de Pearson
teoria d'àcids i bases de Pearson
Química analítica, Química inorgànica
- ca teoria d'àcids i bases de Pearson, n f
- ca teoria d'àcids i bases durs i tous, n f sin. compl.
- es concepto ácido-base de Pearson, n m
- es teoría ácido-base de Pearson, n f
- es teoría ácido-base duro-blando, n f
- es teoría HSAB, n f
- en HSAB concept, n
- en HSAB theory, n
- en Pearson acid base concept, n
Química analítica, Química inorgànica
Definición
Teoria d'àcids i bases que es fonamenta en l'estabilitat dels complexos que formen.
Nota
-
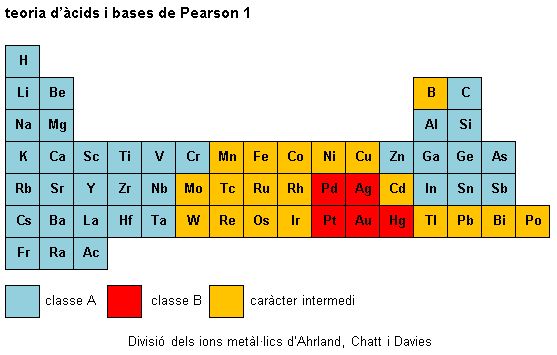
A partir de les dades de constants d'equilibri, s'ha observat que els metalls més pesants del bloc p i els últims metalls del bloc d (Cu+, Ag+, Au+, Cd2+, Hg2+, Pd2+, Pt2+, coneguts com a ions metàl·lics de classe B) formen complexos més estables amb els àtoms donadors fòsfor, sofre i iode, segons els ordres d'estabilitats N << P >> As > Sb; O << S > Se » Te i F < Cl < Br < I.
En canvi, els metalls més lleugers del bloc s i el bloc p i els primers metalls del bloc d (Al3+, Co3+, Fe3+, Ti4+, coneguts com a ions metàl·lics de classe A) formen complexos més estables d'acord amb els ordres d'àtoms donadors N >> P > As > Sb; F > Cl > Br > I i O > S > Se > Te.
La proposta de Pearson és que aquests fets empírics es poden generalitzar mitjançant els conceptes de àcid dur, àcid tou, base dura i base tova; segons els quals una base dura, com ara els lligands amb nitrogen, oxigen o fluor, es coordina millor amb un àcid dur, com ara Al3+, Co3+ o Fe3+, i una base tova, com ara els lligands amb fòsfor, sofre o iode, es coordina millor amb un àcid tou, com ara Cu+, Ag+, Au+, Cd2+ o Hg2+.
Ahrland, Chatt i Davies van fer una divisió de la taula periòdica segons la classe a la qual pertanyen els elements que poden actuar com a àcids (vegeu la imatge teoria d'àcids i bases de Pearson 1). Els ions metàl·lics de caràcter intermedi de vegades ho són pel fet que poden presentar diferents estats d'oxidació.
En aquest context, dur i tou són mesures de la polaritzabilitat dels àcids i les bases, en què per polaritzabilitat s'entén la capacitat que el seu núvol de densitat electrònica pugui ser deformat per una altra espècie. Cal remarcar que dur i tou són termes relatius, ja que es tracta d'un model comparatiu. Així, quan es diu que un àcid és dur, en realitat el que es vol dir és que és més dur que altres àcids.
Aquest model permet predir el signe correcte per al canvi d'entalpia associat a una reacció d'equilibri, com es mostra a la imatge teoria d'àcids i bases de Pearson 2, en què d significa dur, t significa tou, a indica que és un àcid i b indica que és una base. Per exemple, el que es mostra a la imatge teoria d'àcids i bases de Pearson 3. Aquest model també resulta molt útil en geoquímica, ja que permet predir en quina forma es trobaran determinats cations a l'escorça terrestre, ja siguin òxids, sulfurs, etc.
La sigla HSAB correspon a la denominació anglesa hard and soft acids and bases ('àcids i bases durs i tous').
teoria d'àcids i bases durs i tous
teoria d'àcids i bases durs i tous
Química analítica, Química inorgànica
- ca teoria d'àcids i bases de Pearson, n f
- ca teoria d'àcids i bases durs i tous, n f sin. compl.
- es concepto ácido-base de Pearson, n m
- es teoría ácido-base de Pearson, n f
- es teoría ácido-base duro-blando, n f
- es teoría HSAB, n f
- en HSAB concept, n
- en HSAB theory, n
- en Pearson acid base concept, n
Química analítica, Química inorgànica
Definición
Teoria d'àcids i bases que es fonamenta en l'estabilitat dels complexos que formen.
Nota
-
A partir de les dades de constants d'equilibri, s'ha observat que els metalls més pesants del bloc p i els últims metalls del bloc d (Cu+, Ag+, Au+, Cd2+, Hg2+, Pd2+, Pt2+, coneguts com a ions metàl·lics de classe B) formen complexos més estables amb els àtoms donadors fòsfor, sofre i iode, segons els ordres d'estabilitats N << P >> As > Sb; O << S > Se » Te i F < Cl < Br < I.
En canvi, els metalls més lleugers del bloc s i el bloc p i els primers metalls del bloc d (Al3+, Co3+, Fe3+, Ti4+, coneguts com a ions metàl·lics de classe A) formen complexos més estables d'acord amb els ordres d'àtoms donadors N >> P > As > Sb; F > Cl > Br > I i O > S > Se > Te.
La proposta de Pearson és que aquests fets empírics es poden generalitzar mitjançant els conceptes de àcid dur, àcid tou, base dura i base tova; segons els quals una base dura, com ara els lligands amb nitrogen, oxigen o fluor, es coordina millor amb un àcid dur, com ara Al3+, Co3+ o Fe3+, i una base tova, com ara els lligands amb fòsfor, sofre o iode, es coordina millor amb un àcid tou, com ara Cu+, Ag+, Au+, Cd2+ o Hg2+.
Ahrland, Chatt i Davies van fer una divisió de la taula periòdica segons la classe a la qual pertanyen els elements que poden actuar com a àcids (vegeu la imatge teoria d'àcids i bases de Pearson 1). Els ions metàl·lics de caràcter intermedi de vegades ho són pel fet que poden presentar diferents estats d'oxidació.
En aquest context, dur i tou són mesures de la polaritzabilitat dels àcids i les bases, en què per polaritzabilitat s'entén la capacitat que el seu núvol de densitat electrònica pugui ser deformat per una altra espècie. Cal remarcar que dur i tou són termes relatius, ja que es tracta d'un model comparatiu. Així, quan es diu que un àcid és dur, en realitat el que es vol dir és que és més dur que altres àcids.
Aquest model permet predir el signe correcte per al canvi d'entalpia associat a una reacció d'equilibri, com es mostra a la imatge teoria d'àcids i bases de Pearson 2, en què d significa dur, t significa tou, a indica que és un àcid i b indica que és una base. Per exemple, el que es mostra a la imatge teoria d'àcids i bases de Pearson 3. Aquest model també resulta molt útil en geoquímica, ja que permet predir en quina forma es trobaran determinats cations a l'escorça terrestre, ja siguin òxids, sulfurs, etc.
La sigla HSAB correspon a la denominació anglesa hard and soft acids and bases ('àcids i bases durs i tous').
teoria d'Arrhenius
teoria d'Arrhenius
Química analítica
- ca teoria de la dissociació electrolítica, n f
- ca teoria d'Arrhenius, n f sin. compl.
- ca teoria de la dissociació iònica, n f sin. compl.
- ca teoria de la ionització d'Arrhenius, n f sin. compl.
- es teoría de Arrhenius, n f
- es teoría de la disociación electrolítica, n f
- es teoría de la disociación iónica, n f
- es teoría de la ionización de Arrhenius, n f
- en Arrhenius ionisation theory, n
- en Arrhenius ionization theory, n
- en Arrhenius theory, n
- en Arrhenius theory of electrolytic dissociation, n
- en Arrhenius theory of ionic dissociation, n
Química analítica
Definición
Teoria segons la qual la dissociació completa dels electròlits forts es dona només en solucions de tipus iònic.
Nota
- La teoria de la dissociació electrolítica és un model proposat per Svante August Arrhenius el 1887 per a explicar la conductivitat de les dissolucions aquoses d'electròlits. Es fonamenta en quatre hipòtesis. En primer lloc, en dissoldre's un electròlit, es dissocia en ions positius i ions negatius, de manera que la dissolució és elèctricament neutra. En segon lloc, els ions es comporten independentment els uns dels altres, sense interaccions entre ells ni amb el dissolvent. En tercer lloc, els electròlits forts es dissocien totalment, mentre que els electròlits febles només ho fan parcialment. En quart lloc, el procés de dissociació d'un electròlit feble és reversible, de manera que s'estableix un equilibri entre les molècules neutres i els seus ions. A partir d'aquesta última hipòtesi, Arrhenius va definir el grau de dissociació d'un electròlit feble i va establir un procediment per a determinar-lo a partir de la seva conductivitat molar. Avui dia aquesta teoria es considera formalment correcta, tret de la segona hipòtesi perquè els ions són solvatats pel dissolvent i interaccionen amb els altres ions de la dissolució. Només s'admet que no hi ha interacció entre ions en una dissolució a dilució infinita, on els ions poden moure's (migrar) independentment sota l'acció d'un camp elèctric.